Published : 11 Aug 2014 12:00 AM
Last Updated : 11 Aug 2014 12:00 AM
அணுவின் தன்மைகளை அறிய வைக்கும் கணிதம்
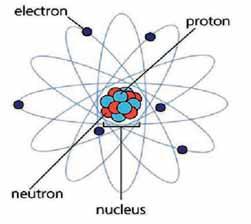
அணுக்களைப் பற்றிய ஆராய்ச்சி கணிதத்தின் துணை இல்லாமல் நடக்குமா? அணுவின் அடிப்படைத் தன்மைகளைக் கணிதத்தின் துணை கொண்டு எப்படி ஆராய்கிறார்கள் என்பதைப் பார்ப்போமா?
இருக்கும்…ஆனா இருக்காது
உலகில் இயங்கும் பொருட்களுக்கு அணுவின் ஆற்றலே காரணம். அணுவைப் பற்றிய ஆராய்ச்சி எப்போதும் இல்லாத அளவுக்குக் கடந்த 150 ஆண்டுகளில் அதிகரித்துள்ளது. ஒரு விஞ்ஞானி முன்வைக்கும் கோட்பாட்டை அது தவறு எனக் காலப் போக்கில் மற்றொரு விஞ்ஞானி நிரூபிக்கிறார்.
அணுவின் தன்மையையும் அதன் உட்பொருளையும் முழுமையாக இன்னும் நாம் மிகச் சரியாக அறியவில்லை. ஆனாலும் அண்மையில் கணிதத்தின் துணையால் பல அறிவியல் ஆய்வுகளில் பெரும் திருப்பங்கள் ஏற்பட்டுள்ளன.
அணுவில் எலெக்ட்ரான், புரோட்டான் மற்றும் நியூட்ரான் என்பவை உள்ளன. புரோட்டானும், நியூட்ரானும் அணுவின் மையத்தில் நியூக்ளியஸ் ஆக உள்ளது. இதைச் சுற்றி எதிர் மின் இயக்கத்தில் எலெக்ட்ரான் சுழன்று கொண்டிருக்கும்.
இதில் நியூட்ரான் மின் இயக்கமே இல்லாமலும், புரோட்டான் நேர் மின் இயக்கத்துடனும், எலெக்ட்ரான் எதிர் மின் இயக்கத்துடனும் சிற்றணுத்துகள்களாக உள்ளன. இதைக் கணிதத்தில் உள்ள பூஜ்ஜியம், மிகை எண்கள் மற்றும் குறை எண்களைக் குறிக்கும் விதத்தோடு ஒப்பிடலாம்.
ஒரு மீட்டரை நூறு கோடி பங்குகளாக பிரித்தால் அதன் ஒரு பங்கே நானோ மீட்டர். 0.1 முதல் 0.5 நானோ மீட்டர்கள் நீள அளவில் அணுக்கள் உள்ளன. இவ்வளவு சிறிய அணுவை நம் கண்களால் காண இயலாது. இருக்கும். ஆனா இருக்காது கதைதான்.
அணுவை அறிய கணித சமன்பாடுகள்
அணுவின் தன்மைகளைத் தகுந்த சமன்பாடுகளைக் கொண்டே அறிய முடியும். இதற்குக் கணிதம் பேருதவி புரிகிறது. இன்றைய மிகச் சிறந்த அறிவியல் உண்மைகளைக் கணிதச் சமன்பாடுகள் மூலமே அறிகிறார்கள்.
அணுவின் இயக்கத்தில் மொத்தம் நான்கு அணுவகச் சுற்றுப் பாதைகள் அமைந்துள்ளன. அவை s, p, d, f அணுவகச் சுற்றுப் பாதைகள் என முறையே அழைக்கப்படுகின்றன. இந்த நான்கு வகை அணுவகச் சுற்றுப் பாதைகளில் அமையும் அணுவின் எண்ணிக்கையை வைத்து ஒரு பொருளை மிகச் சரியாக அறிந்து கொள்ளலாம். இந்த எண்ணிக்கையை அறிந்து கொள்ளக் கணிதம் நமக்குத் துணை புரியும். உதாரணமாக s, p, d, f என்ற அணுவகச் சுற்றுப் பாதைகளில் 2, 6, 10. 14 எலெக்ட்ரான்கள் அதன் அணுவக உட்சுற்றுப் பாதைகளில் காணப்படுகின்றன. இதற்கு என்ன காரணம்?
ஒவ்வொரு அணுவக உட்சுற்றுப் பாதையிலும் இரு எலெக்ட்ரான்கள் வீதம் (ஒன்று கடிகார முள் திசையிலும், மற்றொன்று கடிகார முள்ளின் எதிர்த் திசையில் சுழலும்) அமைகின்றன. s, p, d, f ஆகிய அணுவகச் சுற்றுப் பாதைகளில் 1, 3, 5, 7 ஆகிய ஒற்றைப்படை எண்ணிக்கையுடைய உட்சுற்றுப் பாதைகள் அமைவதால் 2, 6, 10, 14 எலெக்ட்ரான்களின் எண்ணிக்கையை s, p, d, f அணுவகச் சுற்றுப் பாதைகளில் நாம் பெறுகிறோம்.
திசையமைவு
மேற்கூறிய உட்சுற்றுப் பாதைகளின் எண்ணிக்கை ‘திசையமைவு’ என்ற கணித அடிப்படையிலேயே அமைகிறது. உதாரணமாக p அணுவகச் சுற்றுப் பாதையில் (எலெக்ட்ரான்களின் திசையமைவிற்கேற்ப) -1, 0, 1 ஆகிய மூன்று எண்களின் எண்ணிக்கையில் அமைந்த உட்சுற்றுப் பாதைகளும், d அணுவகச் சுற்றுப் பாதையில் -2, -1, 0, 1, 2 ஆகிய ஐந்து எண்களின் எண்ணிக்கையில் அமைந்த உட்சுற்றுப் பாதைகளும், f அணுவகச் சுற்றுப் பாதையில் -3, -2, -1, 0, 1, 2, 3 ஆகிய ஏழு எண்களின் எண்ணிக்கையில் அமைந்த உட்சுற்றுப் பாதைகளும் அமைகின்றன. இப்பண்பைப் படத்தின் மூலம் காணலாம்.
4n–2 என்ற சூத்திரம்
2, 6, 10, 14 எலெக்ட்ரான்களின் எண்ணிக்கையைக் குறிக்கும் எண்களின் வரிசையைக் கணிதத்தில் “கூட்டுத் தொடர் வரிசை” என அழைப்போம். நாம் 4n – 2 என்ற சூத்திரத்தில் n = 1, 2, 3, 4 எனப் பிரதியிட 2, 6, 10, 14 ஆகிய எலெக்ட்ரான்களின் எண்ணிக்கையை s, p, d, f அணுவகச் சுற்றுப் பாதைகளில் முறையே பெறலாம்.
எவ்வளவு எளிமையான சூத்திரம் மூலம் அணுவகச் சுற்றுப் பாதைகளில் அமையும் எலெக்ட்ரான்களின் எண்ணிக்கையைக் கணக்கிட முடிகிறது பாருங்கள்? மிகப் பெரிய ரகசியங்களை எளிமையான சமன்பாடுகள் மற்றும் சூத்திரங்கள் மூலம் அறிந்து கொள்ளலாம்! இது தான் கணிதத்தின் அருமை!
தொடர்புக்கு: piemathematicians@yahoo.com
FOLLOW US
Sign up to receive our newsletter in your inbox every day!



WRITE A COMMENT